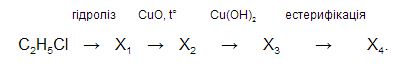Зовнішнє незалежне оцінювання 2011 року з хімії
1. Укажіть протонне число хімічного елемента, в атомі якого на зовнішньому енергетичному рівні міститься 5 електронів.
2. У медичній діагностиці та для дослідження взаємодії лікарських, засобів використовують радіоактивний нуклід 13N. Укажіть число нейтронів у ядрі цього нукліда.
3. Укажіть електронну формулу атома хімічного елемента, хімічна формула вищого оксиду якого Е2O3.
4. В атомі s-елемента на зовнішньому енергетичному рівні міститься два електрони. Молярна маса його гідроксиду становить 74 г/моль. Скільки електронів в атомі цього хімічного елемента?
5. Укажіть символи хімічних елементів малого періоду періодичної системи Д.І. Менделєєва.
6. Як змінюється будова електронної оболонки атомів хімічних елементів 2-го періоду зі зростанням протонного числа?
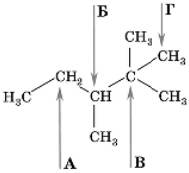
7. На якій схемі зображено перекривання електронних хмар атомів у молекулі гідроген броміду?
9. Укажіть з-поміж чотирьох хімічних елементів той, ступінь окислення якого в бінарній сполуці а Бромом вищий за ступені окиснення інших.
10. Питна сода - широко застосовуваний у побуті й харчовій промисловості розпушувач тіста - це сіль
11. Бінарну сполуку Силіцію з Карбоном - дуже міцний і твердий матеріал карборунд - використовують для шліфування та гранування дорогоцінного каміння. Які кристалічні ґратки в цієї речовини?
12. Укажіть суму коефіцієнтів хімічного рівняння реакції термічного розкладання аргентум(І) нітрату.
16. Укажіть послідовність типів хімічних реакцій, що відповідають перетворенням 1 і 2 за схемою
(1) (2)CH8 – CH2Cl → CH3 – CH2OH → CH2 = CH2.
17. На Донбасі внаслідок багаторічного промислового вуглевидобутку утворилося багато відкритих накопичувачів із напіврідкою сумішшю води з дрібним вугіллям. Укажіть метод очищення шахтних вод від нього.
20. Укажіть речовини, що у водному розчині дисоціюють з утворенням катіонів Гідрогену.
1) сульфатна кислота
2) бінарна сполука Брому з Гідрогеном
3) натрій сульфат
4) найпростіша сполука Нітрогену з Гідрогеном
5) продукт гідратації сульфур(ГУ) оксиду
6) газуватий продукт термічного розкладання калій перманганату
1) сульфатна кислота
2) бінарна сполука Брому з Гідрогеном
3) натрій сульфат
4) найпростіша сполука Нітрогену з Гідрогеном
5) продукт гідратації сульфур(ГУ) оксиду
6) газуватий продукт термічного розкладання калій перманганату
22. Яка дія сприятиме зміщенню хімічної рівноваги реакції
CO2(г.) + H2(г.) ↔ CO(г.) + H2O(г.); ΔH > 0
в бік утворення карбон(IV) оксиду?
CO2(г.) + H2(г.) ↔ CO(г.) + H2O(г.); ΔH > 0
в бік утворення карбон(IV) оксиду?
23. Речовини, реакція між якими описується скороченим йонним рівнянням
H+ + OH- = H2O, - це
H+ + OH- = H2O, - це
24. Укажіть типи хімічних реакцій, характерні для етану.
1) гідрування
2) повне окислення
3) заміщення
4) приєднання
5) гідроліз
6) естерифікація
1) гідрування
2) повне окислення
3) заміщення
4) приєднання
5) гідроліз
6) естерифікація
28. У якій із хімічних реакцій підвищення тиску спричинить зміщення хімічної рівноваги в бік утворення реагентів?
34. Укажіть хімічну формулу речовини, водно-спиртовий розчин якої використовують для проведення якісної реакції на крохмаль.
36. Установіть відповідність між хімічними елементами, що в незначній кількості містяться у мінеральній воді «Лужанська», і будовою зовнішніх енергетичних рівнів їхніх атомів.
| 1. Сульфур 2. Хлор 3. Калій 4. Кальцій | А. ...4s2 Б. ...3s23p5 В. ...3s23p4 Г. ...4s1 Д. ...3s23p3 |
37. Установіть відповідність між хімічними формулами сполук і їхньою класифікаційною належністю.
| 1. Na2SO4 2. Fe(OH)2Cl 3. Р2O5 4. HNO3 | А. основна сіль Б. кислотний оксид В. одноосновна кислота Г. нерозчинна основа Д. середня сіль |
38. 2011р. - Міжнародний рік хімії. Одним із проектів, що мають популяризувати цю науку, могло б стати виготовлення для дитячої кімнати штор із зображенням моделей молекул добре відомих речовин. Установіть відповідність між моделями молекул і назвами речовин.
1. 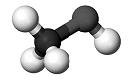 2. 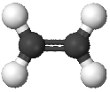 3. 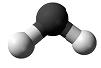 4. 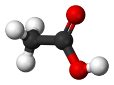 | А. чадний газ Б. вода В. етилен Г. оцтова кислота Д. метиловий спирт |
39. Установіть відповідність між кількістю і масою речовин.
| 1. етан кількістю 2 моль 2. вода кількістю 3 моль 3. кальцій оксид кількістю 0,25 моль 4. амоніак кількістю 4 моль | А. 54 Б. 68 В. 20 Г. 60 Д. 14 |
40. Установіть відповідність між назвами речовин і продуктів їхнього термічного розкладання.
| 1. метан 2. кальцій карбонат 3. калій перманганат 4. ферум(ІІІ) гідроксид | А. кальцій Б. кисень В. вуглець Г. вода Д. карбон(IV) оксид |
41. Установіть послідовність хімічних формул речовин у ланцюжку перетворень від неметалу до оксиду металічного елемента.
А. MgBr2
Б. Mg(OH)2
В. Br2
Г. MgO
А. MgBr2
Б. Mg(OH)2
В. Br2
Г. MgO
42. Розташуйте сполуки за зростанням їхніх кислотних властивостей.
А. етанова кислота
Б. етанол
В. карбонатна кислота
Г. фенол
А. етанова кислота
Б. етанол
В. карбонатна кислота
Г. фенол
43. Розташуйте напівсхеми хімічних реакцій за зменшенням суми коефіцієнтів у відповідних хімічних рівняннях.
А. Cl2 + H2 →
Б. Ca + Cl2 →
В. Ca + O2 →
Г. Fe + Br2 →
А. Cl2 + H2 →
Б. Ca + Cl2 →
В. Ca + O2 →
Г. Fe + Br2 →
44. Розташуйте символи хімічних елементів за збільшенням числа енергетичних рівнів в електронній оболонці їхніх атомів.
А. S
Б. C
В. Fe
Г. I
А. S
Б. C
В. Fe
Г. I
45. Розташуйте назви хімічних елементів за збільшенням числа електронів на зовнішньому енергетичному рівні їхніх атомів.
А. Хлор
Б. Фосфор
В. Оксиген
Г. Калій
А. Хлор
Б. Фосфор
В. Оксиген
Г. Калій
46. Установіть послідовність хімічних формул речовин у ланцюжку перетворень алкену на циклоалкан.
А. C2H4
Б. C2H2
В. C6H12
Г. C6H6
А. C2H4
Б. C2H2
В. C6H12
Г. C6H6
47. Розташуйте хімічні формули за збільшенням кількості речовини у їхніх порціях масою 128 г.
А. SO2
Б. CuO
В. Cu2S
Г. S
А. SO2
Б. CuO
В. Cu2S
Г. S
48. Розташуйте неметали за зростанням їхніх окиснювальних властивостей.
А. кисень
Б. бром
В. фтор
Г. водень
А. кисень
Б. бром
В. фтор
Г. водень
49. Розташуйте гази за зростанням їхньої відносної густини за воднем.
А. метан
Б. кисень
В. карбон(IІ) оксид
Г. гідроген сульфід
А. метан
Б. кисень
В. карбон(IІ) оксид
Г. гідроген сульфід
50. Установіть послідовність речовин у ланцюжку перетворень спирту на сіль.
А. етаналь
Б. натрій етаноат
В. етанол
Г. етанова кислота
А. етаналь
Б. натрій етаноат
В. етанол
Г. етанова кислота
51. Укажіть суму протонних чисел хімічних елементів, прості речовини яких є найпоширенішими дезінфектантами води на водопровідних станціях.
52. Обчисліть об’єм (л) кисню, необхідного для повного окиснення етину об’ємом 2 л (об’єми газів виміряно за однакових умов).
53. Випари ртуті дуже небезпечні для здоров’я. Для хімічної демеркуризації використовують розбавлений водний розчин калій перманганату, підкислений хлоридиою кислотою:
KMnO4 + HCl + Hg → HgCl2 + MnO2 + KCl + H2O. Використовуючи метод електронного балансу, складіть хімічне рівняння окисно-відновної реакції, що відповідає цій схемі. У відповіді зазначте коефіцієнт біля формули сполуки, що є відновником.
KMnO4 + HCl + Hg → HgCl2 + MnO2 + KCl + H2O. Використовуючи метод електронного балансу, складіть хімічне рівняння окисно-відновної реакції, що відповідає цій схемі. У відповіді зазначте коефіцієнт біля формули сполуки, що є відновником.
54. Обчисліть масову частку (%) лугу в розчині, для виготовлення якого було взято натрій гідроксид кількістю 0,25 моль і воду об’ємом 40 мл.
55. У водному розчині натрій карбонату кількість катіонів Натрію становить 1 моль. Обчисліть масу (г) нагрій карбонату, декагідрату, використаного для виготовлення цього розчину.
56. У газі, який унаслідок анаеробного розкладання органічних відходів утворюється на сміттєвих звалищах, об’ємна частка метану така сама, як і карбон(IV) оксиду - 50 %. Обчисліть об’єм (л) кисню, що витратиться під час спалювання цієї суміші об’ємом 20 л (об’єми газів виміряно за однакових умов).
57. Бромуванням бензену масою 156 г добули бромобензен масою 251,2 г. Обчисліть вихід (%) бромобензену від теоретичного.
58. У промисловості будівельний гіпс добувають випалюванням природного гіпсу, який внаслідок цього зневоднюється. Обчисліть масу (г) кристалізаційної води у природному гіпсі масою 86 г.
59. Молярна маса одного з найвідоміших вітамінів у чотири рази більша за молярну масу карбон(IV) оксиду. Співвідношення мас хімічних елементів у молекулі речовини-вітаміну таке:
m(C) : m(H) : m(O) - 9 : 1 : 12.Укажіть число атомів у молекулі цієї сполуки.
60. Суміш масою 200 г, що складалася з кальцій карбонату і кальцій нітрату, обробили надлишком хлоридної кислоти. Внаслідок цього утворився газ об’ємом 8,96 л (н. у.). Обчисліть масову частку (%) кальцій нітрату у вихідній суміші.